一、实验原理
蛋白质纯化的核心原理是利用目标蛋白与杂质之间在物理化学性质上的差异,通过不同的分离技术实现选择性分离。这些性质差异主要包括:
l 分子大小差异(凝胶过滤层析)
l 表面电荷差异(离子交换层析)
l 疏水性差异(疏水相互作用层析)
l 生物特异性相互作用(亲和层析)
l 溶解度差异(盐析)
l pl差异(等电点沉淀)
二、实验步骤
1.前处理
分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态,不丢失生物活性。
然后根据不同的情况,选择适当的方法,将组织和细胞破碎。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来,细胞碎片等不溶物用离心或过滤的方法除去。
2.粗分离
当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选择一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。
一般这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方法。这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。
有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,则可采用超过滤、凝胶过滤、冷冻真空干燥或其他方法进行浓缩。
3.细分离
进一步纯化,一般使用层析法包括凝胶过滤层析、离子交换层析、疏水相互作用层析以及亲和层析等。必要时还可选择电泳法,包括区带电泳、等电点聚焦等作为最后的纯化步骤。
4.结晶(部分)
结晶过程本身也伴随着一定程度的纯化,而重结晶又可除去少量夹杂的蛋白。
三、常用的蛋白质纯化技术
1.疏水相互作用层析
【原理】高盐条件下蛋白质疏水区域与填料结合,降低盐浓度时疏水作用减弱而逐步洗脱。
【优点】
l 适合疏水性较强的蛋白(如膜蛋白片段)
l 条件温和(无需有机溶剂或变性剂)
【缺点】
l 高盐上样可能引发蛋白沉淀
l 分辨率低于IEC或亲和层析
【常见问题】
l 蛋白不结合:盐浓度不足(常用1~2M(NH4)SO4)
l 洗脱困难:疏水性过强(可添加低浓度去垢剂或乙二醇)
【注意事项】
l 避免盐浓度骤变导致蛋白聚集
l 结合后需逐步降低盐浓度洗脱
2.凝胶过滤层析
【原理】利用多孔凝胶颗粒按蛋白质分子大小分离,大分子先流出,小分子因进入孔径滞留而延迟洗脱。
【优点】
l 条件温和(无需结合/洗脱,缓冲液兼容性好)
l 适用于分离复合物或寡聚体(如分析蛋白聚合状态)
l 可同时脱盐或更换缓冲液
【缺点】
l 分辨率较低,需与其他方法联用
l 上样量小(通常<5%柱体积)<>
l 流速慢,耗时较长
【常见问题】
l 结合不牢:pH或离子强度未优化(需预实验确定pl)
l 洗脱峰拖尾:梯度不连续或柱子未再生(需彻底清洗树脂)
【注意事项】
l 避免超载或样品粘度过高(需离心/过滤样品)
l 柱子保存需防干燥(含20%乙醇或NaN3防腐)
3.亲和层析
【原理】依赖蛋白标签(如His-Tag)或生物分子间特异性相互作用(如抗体-抗原)选择性捕获目标蛋白。
【优点】
l 一步纯化即可获得高纯度(>90%)
l 载量高,适合低丰度蛋白
【缺点】
l 标签可能影响蛋白功能(需后续切除)
l 成本高(如抗体柱只限实验室规模)
【常见问题】
l 非特异性结合:His-Tag纯化时咪唑洗脱不彻底(优化咪唑梯度)
l 标签脱落:金属离子螯合柱(Ni-NTA)可能漏金属(改用Co2+柱更稳定)
【注意事项】
l 洗脱后需透析去除咪唑或还原剂(如GST标签用还原型谷胱甘肽)
l 防止柱再生过度导致配基流失
【常用蛋白纯化标签】
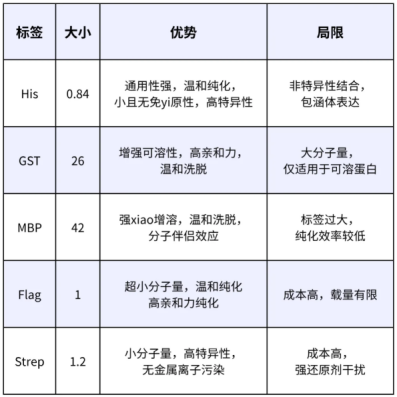
4.盐析
【原理】利用高浓度中性盐与蛋白质分子争夺水分子,降低蛋白质溶解度使其沉淀。
【优点】
l 操作简单,成本低,适合大规模粗提
l 可浓缩蛋白
【缺点】
l 分辨率低,需后续纯化
l 高盐可能干扰下游实验(需透析)
【常见问题】
l 沉淀不完全:盐浓度不足或pH偏离pl
l 蛋白失活:局部盐浓度过高(缓慢加盐并搅拌)
【注意事项】
l 分段盐析(如30%~60%饱和度)可提高特异性
l 低温操作以减少变性风险
5.等电点沉淀
【原理】调节pH至蛋白质等电点(pl)使其表面净电荷为零,溶解度最小而聚集沉淀。
【优点】
l 无需特殊试剂,快速粗提
【缺点】
l 仅适用于pl差异大的蛋白
l 易共沉淀杂质
【常见问题】
l 沉淀不可逆:过度酸化/碱化导致变性(需精确控制pH)
【注意事项】
l 先测定目标蛋白pl(如通过生物信息学预测)
l 与其他方法联用(如先盐析后等电点沉淀)
四、蛋白质纯化注意事项
在进行任何一种蛋白质纯化的时候,都要时刻注意维护它的稳定性,保护它的活性,有一些通用的注意事项需要牢记:
1. 操作尽可能置于冰上或者在冷库内进行。
2. 合适的pH,除非是进行聚焦层析,所使用的缓冲溶液pH避免与pl相同,防止蛋白质的沉淀。
3. 使用蛋白酶抑制剂,防止蛋白酶对目标蛋白的降解;在纯化细胞中的蛋白质时,加入DNA酶降解DNA,防止DNA对蛋白的污染。
4. 避免样品反复冻融和剧烈搅动,以防蛋白质的变性。
5. 缓冲溶液成分尽量模拟细胞内环境。
6. 在缓冲溶液中加入0.1~1mmol/LDTT(二硫苏糖醇)(或β-巯基乙醇),防止蛋白质的氧化。
7. 加1~10mmol/LEDTA金属蝥合剂,防止重金属破坏目标蛋白。
8. 使用灭菌溶液,防止微生物生长。
实验外包 想了解更多请关注:https://www.do-gene.com




